Qu’est-ce que l’incinération ?
L’incinération est une technique de gestion des déchets utilisée pour traiter les déchets municipaux, les biosolides, les déchets industriels et médicaux dangereux et non dangereux, ainsi que d’autres liquides, résidus et gaz toxiques et inflammables rejetés dans l’environnement de manière inacceptable. L’incinération transforme ces déchets en gaz de combustion, en cendres et en chaleur, les cendres étant principalement constituées de substances inorganiques non combustibles.

Pour certains déchets, comme l’incinération de fumées, de liquides sans cendres ou de solides, l’incinération peut être appelée élimination. Mais pour la plupart des déchets solides ou liquides, l’incinération ne sera qu’une étape du traitement des déchets, les résidus restant pour une élimination ultérieure. Il est important de noter que seules les substances combustibles seront incinérées. Les substances non combustibles sont rejetées dans les cendres ou dans les gaz de combustion, en fonction de leur point d’ébullition.
L’incinération offre les avantages potentiels suivants :
- Réduction du volume
- Détoxification
- Atténuation de l’impact environnemental
- Conformité réglementaire
- Récupération d’énergie
Cinétique de la combustion
L’incinération est une réaction de combustion, qui implique plusieurs réactions chimiques. Ce processus de combustion dépend de la température, de la concentration des substances qui réagissent et, dans certains cas, de la pression statique. La cinétique de la combustion explique comment ces relations affectent la vitesse de la réaction. Ce qui différencie l’incinération de la plupart des procédés de combustion, c’est que l’objectif premier est d’obtenir une réaction complète à 100 %, c’est-à-dire la destruction complète des déchets, et non la libération d’énergie. Ceci est particulièrement important pour l’incinération des déchets dangereux.
Les réactions les plus importantes à noter sont l’oxydation des carbones et des hydrocarbures pour former des gaz de combustion ; l’oxydation du monoxyde de carbone ; la formation d’oxydes d’azote, d’oxydes de soufre et d’halogènes et de leurs acides.
Lorsque les déchets sont chargés dans un incinérateur, la réaction initiale est la combustion de ces déchets, ou plus précisément l’oxydation des carbones et des hydrocarbures pour former des gaz de combustion et des cendres. La réaction des carbones et des hydrocarbures nécessite de l’oxygène et ne démarre qu’à la température d’inflammation de ces déchets. La teneur en humidité (quantité d’eau contenue dans les déchets) aura également une incidence sur la vitesse de réaction, car l’eau doit également être évaporée (bouillie). Il s’agit d’une réaction endothermique, car les molécules de liquide doivent absorber de la chaleur pour se transformer en molécules de gaz. Ainsi, la teneur en humidité affectera également la quantité de chaleur libérée par la réaction et la quantité de combustible auxiliaire nécessaire.
Monoxyde de carbone
Le monoxyde de carbone est un gaz inodore, invisible et toxique, et un important polluant atmosphérique. Le monoxyde de carbone est produit par une combustion incomplète, souvent près du foyer de l’incinérateur où les déchets sont densément emballés dans des zones à faible teneur en oxygène, ou en tant que produit de combustion intermédiaire. La cinétique du monoxyde de carbone a été bien étudiée, et la figure 1 indique la relation entre la température et la vitesse de réaction.

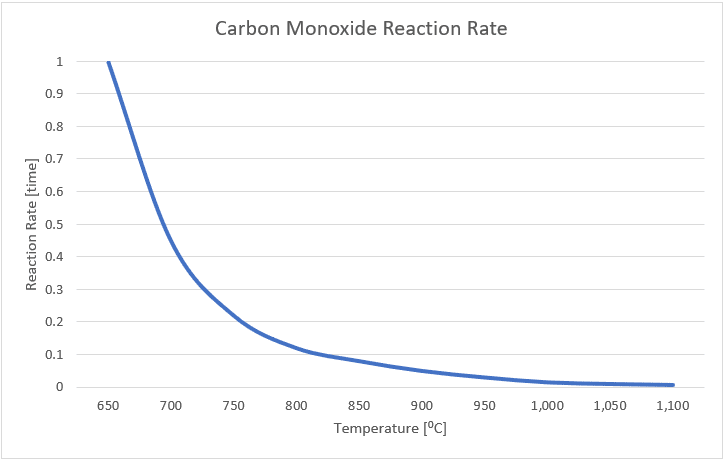
FIGURE 1 : Vitesse de réaction du monoxyde de carbone
Pour une combustion complète (du monoxyde de carbone et d’autres substances), on entend souvent parler de temps, de température et de turbulence. Malheureusement, les flux de gaz de combustion des véritables incinérateurs n’ont pas un temps ou une température unique caractérisant leur histoire dans le système. Il est probable que la plupart des substances non oxydées ne constituent pas un « talon » résiduel d’une réaction globale, mais plutôt les substances non réagies de paquets de gaz de combustion qui n’ont jamais atteint des conditions de combustion satisfaisantes. Ces « modes de défaillance » ne sont pas toujours facilement identifiables, car la température moyenne, la concentration en oxygène et le temps de séjour peuvent tous être satisfaisants. Cependant, une certaine fraction du débit du système n’atteint pas les seuils de paramètres critiques qui assurent la combustion. En général, si l’on n’obtient qu’une destruction de 99 % d’une matière d’alimentation, ce n’est pas parce que 100 % du flux est brûlé à 99 %, mais plus probablement parce que 99 % du flux est entièrement brûlé et que 1 % n’a pas brûlé du tout. On peut se représenter le flux total traversant un incinérateur comme un composite d’un grand nombre de petits paquets de gaz individuels, chacun ayant sa propre composition et son propre historique temps-température. L’impossibilité d’obtenir une combustion complète pourrait être due à une fraction des paquets qui s’écoulent où :
- L’incinérateur ne mélange pas suffisamment d’air au combustible.
- Le système mélange suffisamment d’air pour que la combustion soit complète, mais le passage du paquet sur des surfaces froides maintient ou amène la température en dessous du seuil d’allumage où se produisent des réactions d’oxydation rapides.
- Le système mélange une quantité excessive d’air qui, par dilution, amène la température en dessous du seuil d’allumage, où se produisent des réactions d’oxydation rapides.
- Le système comprend des voies d’écoulement telles que certains paquets de gaz, autrement capables de brûler, se déplacent trop rapidement dans les régions chaudes du four et sont refroidis en dessous des températures de combustion avant de s’oxyder.
Oxydes d’azote (NOx)
Les oxydes d’azote (NOx) représentent un groupe de sept composés, le NO₂ servant normalement de substitut au groupe car il s’agit de la forme la plus répandue de NOx. Les NOx constituent un groupe important de gaz hautement réactifs, et d’importants polluants. Le NO₂ est non seulement un polluant important en soi, mais il réagit également dans l’atmosphère pour former de l’ozone (O₃) et des pluies acides.
Dans les systèmes de combustion, les oxydes d’azote proviennent de la fixation de l’azote de l’air de combustion avec l’oxygène (génération thermique). En outre, les NOx sont formés par l’oxydation de l’azote qui entre dans le système et qui est lié au carburant (génération d’azote dans le carburant). À très haute température, la source dominante de NOx est la génération thermique mais, à plus basse température, les mécanismes de l’azote du combustible dominent.
Les NOx se forment dans les systèmes de combustion de l’une des trois manières suivantes :
- NOx thermique – se forme généralement au-dessus de 1 400⁰C, et la formation augmente de manière significative avec l’augmentation des températures. La formation est généralement contrôlée en réduisant les températures de pointe et moyenne de la flamme.
- NOx du carburant – formé par l’oxydation de l’azote entrant dans le système et lié au carburant.
- NOx rapides – formés à partir de l’azote moléculaire présent dans l’air qui se combine au carburant dans des conditions riches en carburant qui existent, dans une certaine mesure, dans toutes les combustions. Cet azote s’oxyde ensuite avec le carburant et devient du NOx pendant la combustion, tout comme le NOx du carburant.
La technologie de réduction et de contrôle des NOx est une question relativement complexe et est définie de manière générale comme une méthode de prévention de la pollution ou une méthode complémentaire. Technologie de réduction .
Oxydes de soufre
De nombreux flux de déchets et combustibles fossiles contiennent du soufre. Le soufre peut être présent dans un ou plusieurs de ses nombreux états d’oxydation, de S-2 à S+6. Le soufre qui se présente sous forme de soufre organique ou inorganique (pyrite), de soufre libre ou de soufre sous forme d’acide organique ou inorganique est particulièrement intéressant du point de vue de la pollution atmosphérique. Dans chacun de ces cas, on peut s’attendre à ce que le soufre apparaisse dans les gaz de combustion sous forme de dioxyde ou de trioxyde de soufre. Une partie du soufre présent sous forme de sulfates inorganiques dans les combustibles ou les déchets tels que les plaques de plâtre (sulfate de calcium) peut être libérée par des réactions de réduction, en particulier dans l’environnement à haute température de la grille des incinérateurs à combustion massive.
Les oxydes de soufre sont importants en tant que polluants en raison de leurs effets sur la santé (notamment en combinaison avec les particules respirables) et de leurs effets corrosifs sur les matériaux naturels et artificiels. Dans le système de combustion, le trioxyde de soufre réagit avec la vapeur d’eau pour former de l’acide sulfurique, dont le point de rosée est nettement supérieur à celui de l’eau pure.
Pour plus d’informations, consultez notre guide sur la réduction des émissions de gaz de combustion des incinérateurs.
Les halogènes et leurs acides
Les halogènes sont des constituants importants des déchets. Certains des composés organiques des halogènes sont toxiques, cancérigènes ou préoccupants pour leurs effets sur la santé. En outre, les gaz acides formés pendant la combustion sont des acides forts qui peuvent attaquer les métaux (par exemple, dans les chaudières) et être très corrosifs dans leurs solutions aqueuses dans les épurateurs. Le chlore et l’acide chlorhydrique sont généralement les membres les plus importants de cette famille, bien que le fluor, le brome, l’iode et leurs acides puissent être plus problématiques dans la conception, l’exploitation et le contrôle des polluants des systèmes.
Le chlore apparaît dans les flux de déchets à la fois dans les sels inorganiques (par exemple, le chlorure de sodium) et dans les composés organiques. Lors de la combustion de nombreux déchets industriels et, surtout, des déchets urbains solides, une quantité importante de matières organiques contenant du chlore peut être chargée dans le four. Dans l’environnement de combustion (contenant généralement de l’hydrogène en excès considérable par rapport au chlore), le chlore organique est transformé, presque quantitativement, en chlorure d’hydrogène (acide chlorhydrique). Dans les incinérateurs à combustion massive, environ 35-40% du HCl stœchiométrique généré par la combustion est absorbé par les constituants alcalins des cendres (Na2O, CaO, etc.).
